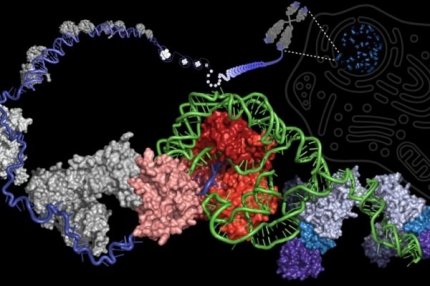
В ходе исследований, проведенных в лабораториях профессора Джулиана Чена в Школе молекулярных наук при Аризонском государственном университете, ученые смогли сделать решающий шаг в каталитическом цикле фермента теломеразы, сообщает Science Dayli.
Этот цикл определяет способность фермента теломеразы человека синтезировать «повторы» ДНК (специфические сегменты ДНК из шести нуклеотидов) на концах хромосом и, таким образом, «создавать» бессмертие в клетках. Понимание основополагающего механизма действия теломеразы предлагает новые возможности для эффективной терапии против старения.
Типичные человеческие клетки смертны и не могут обновляться постоянно. Как продемонстрировал Леонард Хейфлик полвека назад, человеческие клетки имеют ограниченную репликативную продолжительность жизни, причем более старые клетки достигают этого предела раньше, чем более молодые.
Этот «предел Хейфлика» ‒ срока жизни клетки ‒ напрямую связан с количеством уникальных повторов ДНК, обнаруженных на концах хромосом, несущих генетический материал. Повторы являются частью защитных структур, называемых «теломерами», которые защищают концы хромосом от нежелательных и неоправданных перегруппировок ДНК, дестабилизирующих геном.
Каждый раз, когда клетка делится, теломерная ДНК сжимается и в конечном итоге не сможет защитить концы хромосом. Это непрерывное сокращение длины теломер функционирует как «молекулярные часы», которые отсчитывают время до конца срока роста клетки. Уменьшающаяся способность клеток к росту напрямую связана с процессом старения, при этом уменьшенное количество клеток непосредственно отвечает за слабости и болезни всего организма.
Противодействием процессу уменьшения теломер является фермент, теломераза, который заключает в себе ключ от задержки или даже изменения процесса клеточного старения. Теломераза компенсирует старение клетки, удлиняя теломеры, добавляя обратно потерянные повторы ДНК, чтобы приостановить молекулярные часы, эффективно увеличив продолжительность жизни клетки.
Однако активности фермента теломеразы недостаточно для полного восстановления утраченных повторов теломерной ДНК или для прекращения клеточного старения.
«Теломераза имеет встроенную тормозную систему для обеспечения точного синтеза правильных повторов теломерной ДНК. Однако этот безопасный тормоз также ограничивает общую активность фермента теломеразы, - отметил профессор Чен. - Поиск способа правильного выпуска тормозов в работе теломеразы может восстановить потерянную длину теломер взрослых стволовых клеток и даже обратить вспять клеточное старение».
Такие болезни как адгезивная дискератоза, апластическая анемия и идиопатический фиброз легких генетически связаны с мутациями, которые отрицательно влияют на активность теломеразы и ускоряют потерю длины теломер. Это напоминает преждевременное старение с повышенным повреждением органов и сокращением продолжительности жизни пациентов из-за критически недостаточных популяций клеток. Увеличение активности теломеразы является, по словам исследователей, наиболее перспективным средством лечения этих заболеваний.